তড়িৎ রসায়ন, রসায়নের সাথে তড়িৎ এর এক যুগলবন্দী। মনে হতে পারে যে, রসায়ন এবং তড়িৎ কী করে একসূত্রে গাঁথল? এক কথায় এর উত্তর হল, পরমাণুর চার্জযুক্ত ইলেকট্রন-প্রোটন। পরমাণুর ইলেকট্রন-প্রোটন এর লেনদেন এবং তদসংশ্লিষ্ট খুঁটিনাটির মাধ্যমেই রসায়ন এবং তড়িৎ এক বিন্দুতে এসে মিলেছে। তড়িৎ-রসায়নের এই যুগলবন্দী’র খুঁটিনাটি বিষয়াদি এবং কিছু ব্যাখ্যা-বিশ্লেষণ নিয়েই আমাদের এ সিরিজ ‘তড়িৎ রসায়ন’।
তড়িৎ রসায়ন নিয়ে আমরা মূলত দেখবঃ
তড়িৎ বিশ্লেষণ ও এর নিয়ামকসমূহ, গ্যালভানিক কোষ, এদের কার্যপ্রণালী, ফ্যারাডের সূত্র, তড়িৎ রাসায়নিক তুল্যাঙ্ক, রাসায়নিক তুল্যাঙ্ক, জারণ বিভব, বিজারণ বিভব, সক্রিয়তা, নারনস্ট সমীকরণ ও তড়িৎ রসায়নের প্রয়োগ…
প্রথমে আমরা বিস্তারিত আলোচনা করব ‘তড়িৎ থেকে রসায়ন’ নিয়ে, পরবর্তীতে আলোচনা হবে ‘রসায়ন থেকে তড়িৎ’ নিয়ে। তো শুরু করা যাক,
তড়িৎ থেকে রসায়নঃ
আমরা ইতোমধ্যে জানি যে, তড়িৎ প্রবাহের মাধ্যমে খুব সহজেই রাসায়নিক বিক্রিয়া ঘটানো যায়। এই প্রক্রিয়া’র কেতাবী নাম হল তড়িৎ বিশ্লেষণ। তড়িৎ বিশ্লেষণের মূল বিষয় হল, বিদ্যুৎ প্রবাহের মাধ্যমে কোন যৌগকে বিশ্লেষণ করা। এক্ষেত্রে আমরা বিদ্যুতশক্তিকে রাসায়নিক শক্তি’তে রূপান্তরিত করি।
আমরা সোডিয়াম ক্লোরাইড, পানি ইত্যাদি’র তড়িৎ বিশ্লেষণ দেখে আসছি ক্লাস নাইন থেকে; তো সেই সূত্র ধরে সোডিয়াম ক্লোরাইড দিয়ে পুরো প্রক্রিয়াটা আরও গভীরভাবে আরেকবার রিভিউ করিঃ
(ধরে নিচ্ছি যে, তড়িৎ বিশ্লেষন এর প্রয়োজনীয় যন্ত্রপাতি, ইলেক্ট্রোড , ব্যাটারি, বিশ্লেষ্য এবং প্রক্রিয়া নিয়ে আমাদের কিছুটা হলেও জ্ঞান আছে ) ।
NaCl এর তড়িৎ বিশ্লেষণ এর সময়ে, NaCl এবং H2O দ্রবণে কি অবস্থায় থাকে। দ্রবণে উভয় যৌগই Na+ , Cl– , H+ , OH– এরকমভাবে আয়নিত অবস্থায় থাকে। এখন অ্যানোড-ক্যাথোডের সাথে ব্যাটারির সংযোগ দিলে দ্রবণের নেগেটিভ আয়ন (অ্যানায়ন) পজিটিভ অ্যানোডের দিকে এবং পজিটিভ আয়ন (ক্যাটায়ন) নেগেটিভ ক্যাথোডের দিকে ছুটবে। কিন্তু সমস্যা হল আয়ন’তো এখানে ২ টা করে, পজিটিভ আয়ন ২ টা, নেগেটিভ আয়নও ২ টা। তাহলে কে ছুটবে অ্যানোড ও ক্যাথোডের দিকে?
চিত্রঃ NaCl(aq.) এর তড়িৎ বিশ্লেষণ
এর সমাধান করি আমরা এভাবে, যে আয়ন/মূলক কম সক্রিয় সে আয়ন ছুটবে। আচ্ছা কম সক্রিয়’টাই কেন ইলেক্ট্রোড এর দিকে যাবে? এমন প্রশ্ন মাথায় আসে না? চল দেখা যাক কি কারণে,
এটা বোঝার জন্য আমরা সক্রিয়তা সিরিজ নিয়ে হালকা ধারণা নিয়ে নেই (এ ব্যাপারে বিস্তারিত জানব আমরা পরবর্তীতে, গ্যালভানিক কোষ নিয়ে দেখার সময়ে), যা আমাদের বুঝতে সাহায্য করবে যে, কেন কম সক্রিয় আন্যায়ন-ক্যাটায়ন বিশ্লেষিত হয়।
সক্রিয়তা সিরিজ তৈরি করা হয়েছে মৌলগুলোর বিজারণ বিভব অনুযায়ী। সহজ করে বললে বলতে হয়, মৌল গুলো সাজানো হয়েছে বিজারণ প্রবণতা অনুযায়ী। উপর থেকে নিচ, এই ক্রমে বিজারণ প্রবণতা বাড়ে (বিজারণ বিভব বাড়ে)। যেই মৌলের বিজারণ প্রবণতা যত বেশী (বিজারণ বিভব যত বেশী), সেই মৌল তত সহজে আয়নিত অবস্থা হতে ইলেকট্রন গ্রহণ করে (বিজারণ) মৌল অবস্থায় আসতে পারে। ঠিক বিপরীত কারণে নিচ থেকে উপরে আসলে জারণ বিভব তথা জারণ প্রবণতা বাড়ে।
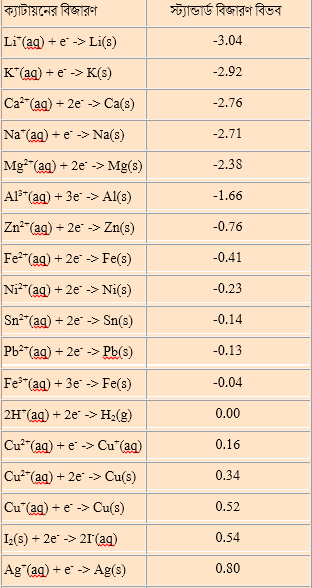
ক্যাটায়নের সক্রিয়তা সিরিজ (বিজারণ বিভব অনুযায়ী)
তড়িৎ বিশ্লেষণে আয়নের সক্রিয়তার প্রভাবঃ
এখন দেখা যাক, তড়িৎ বিশ্লেষণের সময়ে অ্যানোড-ক্যাথোডে কি ঘটে?
আমরা ছবি থেকে দেখতে পাই যে, তড়িৎ বিশ্লেষণের সময়ে ক্যাথোডে বিজারণ ঘটে। পজিটিভ আয়ন ক্যাথোডে এসে ইলেকট্রন গ্রহণ করে বিজারিত হয়। এই বিজারণ প্রবণতা, সক্রিয়তা সিরিজ ধরে কোন দিকে গেলে বাড়বে? একটু আগেই দেখেছি, নিচের দিকে গেলে বাড়ে। অর্থাৎ নিচের দিকের মৌলের বিজারণ প্রবণতা বেশী।
আমাদের চিত্রের ২ টি ক্যাটায়ন, Na+ ও H+ এর মধ্যে H+ এর অবস্থান সিরিজে নিচে তথা এর বিজারিত হওয়ার প্রবণতা বেশী। তাই এক্ষেত্রে H+ ই বিজারিত হবেঃ
ক্যাথোড বিক্রিয়াঃ
2H+ + 2e = H2
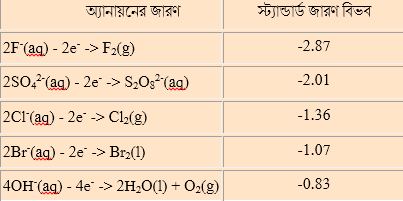
অ্যানায়নের সক্রিয়তা সিরিজ ( জারণ বিভব অনুযায়ী)
(বোঝা’র সুবিধার্থে অ্যানায়নের জন্য আমরা জারণ প্রবণতা অনুযায়ী তথা জারণ বিভব অনুযায়ী সক্রিয়তা সিরিজ’টা সাজিয়েছি)
একইরকম ভাবে আমরা ছবি থেকে দেখতে পাই যে, তড়িৎ বিশ্লেষণের সময়ে অ্যানোডে বিজারণ ঘটে। নেগেটিভ আয়ন (ক্যাটায়ন) অ্যানোডে এসে ইলেকট্রন ছেড়ে দিয়ে জারিত হয়। তাহলে বলুন তো, এই জারণ প্রবণতা, সক্রিয়তা সিরিজ ধরে কোন দিকে গেলে বাড়বে? চার্ট থেকে দেখা যাচ্ছে, অ্যানায়নের জন্যও নিচের দিকে জারণ বিভব তথা জারণ প্রবণতা বাড়ে।
আমাদের চিত্রের ২ টি অ্যানায়ন, Cl– ও OH– এর মধ্যে OH– এর অবস্থান সিরিজে নিচে তথা এর জারিত হওয়ার প্রবণতা বেশী। তাই এক্ষেত্রে OH– ই জারিত হবেঃ
অ্যানোড বিক্রিয়াঃ
4OH–(aq) – 4e– = 2H2O(l) + O2(g)
এবার নিশ্চয়ই বোঝা গেল যে, কেন সক্রিয়তা সিরিজের নিচের মৌল/মূলক আগে যাবে ইলেক্ট্রোডের দিকে।
তবে তড়িৎ বিশ্লেষণ এর এই একটিই নিয়ামক নয়। তড়িৎ বিশ্লেষণ নির্ভর করে বেশ কয়েকটি বিষয়ের উপরঃ
১। সক্রিয়তা সিরিজে আয়নের অবস্থান
২। আয়নের ঘনমাত্রা
৩। ইলেক্ট্রোড এর প্রকৃতি
৪। ইলেক্ট্রোডের পৃষ্ঠতলের ক্ষেত্রফল
৫। বিদ্যুৎ প্রবাহের পরিমাণ
৬। ভোল্টেজ এর পরিমাণ
১ নম্বর পয়েন্ট নিয়ে আমরা উপরেই আলোচনা করেছি। আজকে ২, ৩ ও ৪ নাম্বার পয়েন্ট নিয়ে কিছু কথা দিয়ে শেষ করব।
আয়নের ঘনমাত্রার প্রভাবঃ
দ্রবণে একাধিক আয়ন থাকলে যেই আয়ন এর ঘনমাত্রা বেশী হয় সাধারণত সেই আয়নই বেশী তড়িৎ বিশ্লেষিত হয়। আয়নের ঘনমাত্রার এই প্রভাব আয়নের সক্রিয়তা প্রভাব থেকেও বেশী।
আমাদের চিত্র দিয়েই উদাহরণ দেয়া যাক। চিত্রে যদি NaCl এর ঘনমাত্রা বেশী হয়, তখন , Cl– ও OH– এর মধ্যে Cl– ই জারিত হয়। যদিও সক্রিয়তা সিরিজ অনুযায়ী OH– এর জারিত হওয়ার কথা ছিল।
অ্যানোড বিক্রিয়াঃ
2Cl– – 2e– = Cl2
তবে একই সাথে খুব সামান্য পরিমাণে OH– ও জারিত হয়।
ইলেক্ট্রোডের প্রকৃতি’র প্রভাবঃ
সাধারণত ইলেক্ট্রোড হিসেবে নিষ্ক্রিয় কোন ধাতু (যেমন প্লাটিনাম) বেছে নেয়া হয়। এতে করে ইলেক্ট্রোড এর কোন প্রভাব পড়ে না তড়িৎ বিশ্লেষণে। কিন্তু অনেক সময়ে বিশেষ প্রয়োজনে সক্রিয় ও বিশেষ কার্যকরী ইলেক্ট্রোড বেছে নেয় হয়; যা তড়িৎ বিশ্লেষণে গুরুত্বপূর্ণ ভূমিকা রাখে।
যেমন আমাদের চিত্রের উদাহরণে যদি প্লাটিনামের বদলে পারদ ইলেক্ট্রোড ব্যবহার করা হয় তবে ক্যাথোডে Na+ ও H+ এর মধ্যে Na+ বিজারিত হয়। যদিও সক্রিয়তা সিরিজ অনুযায়ী H+ এর বিজারিত হওয়ার কথা ছিল। পারদ ব্যবহারের ফলে Na+ বিজারিত হওয়ার কারণ হল পারদ (Hg) এর প্রতি Na এর বিশেষ আসক্তি। এ আসক্তির ফলে Na ও Hg এর বিক্রিয়ায় সোডিয়াম-অ্যামালগাম (Na-Hg) তৈরি হয়। এবং এই সোডিয়াম-অ্যামালগাম (Na-Hg) পরবর্তীতে দ্রবণের পানির সাথে বিক্রিয়া করে ব্রাইন (NaOH(aq)) তৈরি করে। বাণিজ্যিক ভাবে এই প্রক্রিয়ায় ব্রাইন উৎপাদন করা হয়।
ক্যাথোড বিক্রিয়াঃ
Na+ + e– = Na
Na + Hg = Na-Hg
Na-Hg + H2O = NaOH(aq) + H2 + Hg
ইলেক্ট্রোডের পৃষ্ঠতলের ক্ষেত্রফলের প্রভাবঃ
ইলেক্ট্রোড এর ক্ষেত্রফল যত বেশী হবে তত বেশী পরিমাণে অ্যানায়ন-ক্যাটায়ন এর সংস্পর্শে আসতে পারবে, তত বেশী পরিমাণে আয়ন জারিত-বিজারিত হবে।
আজকে এই পর্যন্তই, এসবই অধিকাংশের জানা বিষয়; তবুও আরেকবার রিভিউ করলাম। আগামী পর্বে আমরা দেখব তড়িৎ বিশ্লেষণের উপর ৫ ও ৬ নাম্বার নিয়ামকের প্রভাব; দেখব ফ্যারাডের ১ম ও ২য় সূত্র ও তাদের প্রয়োগ এবং তড়িৎ বিশ্লেষণের ব্যবহারিক প্রয়োগ। সেই পর্যন্ত স্বশিক্ষার সাথেই থাকুন 🙂