গত পর্বে পানির বিয়োজন ধ্রুবক, pH ইত্যাদির পরিচয় শেষ করার পর এ পর্বে শুরু করতে যাচ্ছি কোনো অম্ল কিংবা ক্ষারকের শক্তিমাত্রার সূচক বিয়োজন ধ্রুবক এবং তার সাথে সাথে বিভিন্ন ঘনমাত্রার ও বিভিন্ন সবলতার অম্ল বা ক্ষারকের জলীয় দ্রবণের pH, pOH নির্ণয় সংক্রান্ত আলোচনা।
অম্ল কিংবা ক্ষারক কীসের ভিত্তিতে সবল বা দুর্বল হয় তার বিশদ আলোচনা ব্রনস্টেড লাউরির প্রোটনীয় মতবাদ বোঝার সময়ই আমরা দেখে এসেছি। সেগুলো মূলত ছিল তত্ত্বীয় আলোচনা। ভৌত যে রাশির সাহায্যে তাদের শক্তিমাত্রার ধারণা পাওয়া যায় সেটা হল তাদের বিয়োজন ধ্রুবক (Dissociation Constant)। সাধারণত সবল এসিডসমূহ (মূলত খণিজ – HCl, H2SO4, HNO3) পানিতে প্রায় শতভাগ আয়নিত হয় অর্থাৎ পানিতে যোগ করা এদের প্রতিটি অণুই প্রোটন দান করে পানির অণুগুলোকে। তবে ভুলে যাওয়া চলবে না, এই বিক্রিয়া সামান্য হলেও পশ্চাৎবর্তী হয়ে ঘটতে পারে এবং উভমুখী বিক্রিয়া হিসেবে সাম্যাবস্থায় পৌঁছাতে পারে। অন্যদিকে, ইথানয়িক এসিডের (CH3COOH) মত দুর্বল এসিড পানিতে মাত্র 1% আয়নিত হয় এবং এমতাবস্থাতেই বিয়োজন বিক্রিয়াটি সাম্যাবস্থায় উপনীত হয়। এসিডের সাধারণ বিয়োজন বিক্রিয়ার সাপেক্ষে আমরা এদের বিয়োজন ধ্রুবক ভরক্রিয়ার সূত্রানুযায়ী নিম্নভাবে লিখতে পারি :
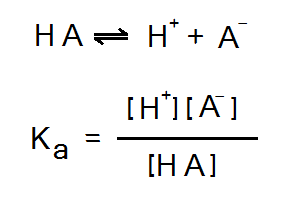
যদিও এখানে কেবল প্রোটন না দেখিয়ে একে পানির সাথে সংযুক্ত অবস্থায় হাইড্রোনিয়াম আয়ন আকারে লেখা উচিত ছিল, তবুও প্রকাশভঙ্গীটা সরল রাখার স্বার্থে আমরা এভাবে লিখেছি।
সবল এসিডগুলোর বিয়োজন অধিকমাত্রায় ঘটে বলে সাম্যাবস্থায় [H+] ও [A–] দের ঘনমাত্রা খুবই বেশি থাকে অবিয়োজিত এসিডের ঘনমাত্রা [HA] এর তুলনায়; সুতরাং Ka এর মানও অত্যন্ত বেশি হয়। HCl এর ক্ষেত্রে এই বিয়োজন ধ্রুবকের মান যেমন 1.3×106 molL-1। অন্যদিকে দুর্বল এসিডের ক্ষেত্রে ঘটনা হয় ঠিক উল্টো যা আমাদের Ka এর অত্যল্প মান উপস্থাপন করে। CH3COOH এর বিয়োজন ধ্রুবক হল 1.8×10-5 molL-1। মনে করিয়ে দেওয়া ভাল, এই সকল Ka এর মান কক্ষতাপমাত্রা বা 25° C এ নেওয়া। অন্যান্য তাপমাত্রায় এই বিয়োজন ধ্রুবক একরকম থাকবে না (কেন থাকবে না আগের পর্বে তা সবিস্তারে আলোচনা করা হয়েছে ইতোমধ্যেই)।
প্রাসঙ্গিকভাবেই এবার চলে আসবে pKa এর কথা যা বরাবরের মতই Ka এর দশভিত্তিক ঋণাত্মক লগারিদম হতে যাচ্ছে। সবল এসিডগুলোর Ka অধিক (1 এর চেয়েও বড়) হবার কারণে এদের pKa হয় 0 এর চেয়ে কম। অন্যদিকে দুর্বল এসিডগুলোর pKa হয় ধনাত্মক কেননা এদের Ka এর মান অতি ক্ষুদ্র। তোমাদের সামনে হাইড্রোক্লোরিক আর ইথানয়িক এসিডের যে বিয়োজন ধ্রুবক দেওয়া আছে তা থেকেই pKa নির্ণয় করে উপরের বক্ত্যবের সত্যতা যাচাই করে নাও।
দুর্বল এবং সবল ক্ষারকদের জন্য বলতে গেলে আমাকে উপরে অম্লের ক্ষেত্রে বলা কথাগুলোই রিপিট করতে হবে (যা নিশ্চয়ই তোমাদের পড়তে ভাল লাগার কথা না, আমার নিজেরই লিখতে আলসেমি আসছে 😛 )। তবু উপর উপর দিয়ে বলে যাই, আয়নিক ক্ষারকসমূহ (NaOH, KOH, Ca(OH)2) পানিতে প্রায় শতভাগ আয়নিত হয় যেখানে অ্যামোনিয়ার মত দুর্বল ক্ষারক আয়নিত হয় কেবল এক শতাংশ (এসিডের জন্য বলা ঐ কথাটাই হয়ে গেল 😛 )।
এখন একটা ভাল প্রশ্ন হতে পারে এমন যে – Ca(OH)2 তো পানিতে দ্রবণীয়ই হতে চায় না তেমন, একে আপনি কীভাবে শতভাগ আয়নিত হয় বলতে পারেন? আচ্ছা! ক্যালসিয়াম হাইড্রক্সাইড পানিতে বেশি পরিমাণে দ্রবণীয় হয় না ঠিক, কিন্তু যতগুলো অণু দ্রবণে চলে আসে তারা সকলেই বিয়োজিত হয়ে হাইড্রক্সাইড তৈরি করে (এভাবেই তো আয়নিক যৌগ ক্যাটায়ন অ্যানায়নে বিশ্লিষ্ট হয়ে দ্রবণ বানায়, নাকি?)। আমাদের চিন্তা তাই যতটুকু ক্যালসিয়াম হাইড্রক্সাইড দ্রবণে গেল, তারা হাইড্রক্সাইড দিতে পারল কিনা পানিতে এটা নিয়ে; যারা দ্রবণীয় হয় না তাদের নিয়ে নয়। পানিতে তো ইথানয়িক এসিডও দ্রবীভূত হয়, কিন্তু তাতে কি এই এসিডের সবটুকু বিয়োজিত হয়ে প্রোটন দান করে? করে না। দ্রবণীয়তার সাথে এক্ষেত্রে তাই আয়নিত হবার বিষয়টা পেঁচিয়ে ফেলা যাবে না।
তবে এই আয়নিক আর অ-আয়নিক ক্ষারকগুলোর মধ্যে একটা মৌলিক পার্থক্য আছে যেটা আমরা হয়ত চোখে দেখেও দেখি নি। তোমরা জানো যে, আয়নিক ক্ষারকগুলো পানিতে দ্রবীভূত হওয়ামাত্রই (কিংবা কেউ পানির সাথে প্রথমে বিক্রিয়া করে নিয়ে, যেমন CaO) হাইড্রক্সাইড আয়ন দান করে, যে হাইড্রক্সাইড প্রকৃত অর্থে ক্ষারকের মত বিক্রিয়া দেয়। কিন্তু অন্যান্য অ-আয়নিক যৌগ যেমন অ্যামোনিয়া কিংবা জৈব অ্যামিনসমূহের অণুতে তো আর হাইড্রক্সাইড আয়ন থাকে না। সেক্ষেত্রে তারা আগে পানি থেকে একটা প্রোটন গ্রহন করে তাদের মুক্তজোড় ইলেকট্রন কাজে লাগিয়ে এবং পানিকে OH– বানিয়ে ফেলে, এই হাইড্রক্সাইড আয়নই এবার কাজ করে প্রশমন বিক্রিয়ায় পানি তৈরি করতে। পানি থেকে প্রোটন টেনে আনার এই বিক্রিয়া যে ক্ষারক যত বেশি ঘটাতে পারবে আল্টিমেটলি সে-ই তত বেশি হাইড্রক্সাইড তৈরি করবে, পাবে তুলনামূলক সবল ক্ষারক হবার মর্যাদা। আমরা এসিডের মত এদের ক্ষেত্রেও বিয়োজন আর বিয়োজন ধ্রুবক Kb এর দিকে চোখ বুলিয়ে নিই।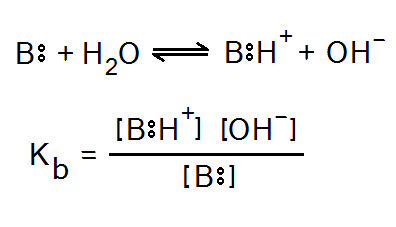 যে প্রশ্নটা এখন আসা উচিত : পানিকে যদি বিক্রিয়াতে রাখিই তবে তার ঘনমাত্রা কেন Kb এর রাশিমালায় আনলাম না? পানির ভূমিকা এসিডের বিয়োজনের সময়েও ছিল প্রোটন গ্রহীতা হিসেবে, এখানেও আছে প্রোটন দাতা হিসেবে। তবে মূল ব্যাখ্যায় আসবে দুইটা পয়েন্ট – ১. সবল এসিড ক্ষারকের ক্ষেত্রে বিয়োজন এত সুন্দর পরিমাণে ঘটে যে দ্রাবক পানির কোনো প্রভাব আলাদা করে উল্লেখের দরকারই পড়ে না এবং ২. দুর্বল অম্ল-ক্ষারকের জন্য সাম্যাবস্থায় যে নগণ্য পরিমাণ পানির অণু জড়িত থাকে এদের বিয়োজন ঘটাতে তার চেয়ে অনেক অনেক বেশিই পানি আমরা প্রারম্ভে নিই (কারণ ঘন দ্রবণ বানালে এদের বিয়োজনপ্রবণতা অনাকাঙ্ক্ষিতভাবে হ্রাস পায়, অসওয়াল্ডের লঘুকরণ সূত্র), এ কারণে বিয়োজন ধ্রুবকের লেখার সময় অবিয়োজিত পানির ঘনমাত্রা লিখে অতিরিক্ত একটা ধ্রুব রাশি আনার চিন্তা করা হয় না।
যে প্রশ্নটা এখন আসা উচিত : পানিকে যদি বিক্রিয়াতে রাখিই তবে তার ঘনমাত্রা কেন Kb এর রাশিমালায় আনলাম না? পানির ভূমিকা এসিডের বিয়োজনের সময়েও ছিল প্রোটন গ্রহীতা হিসেবে, এখানেও আছে প্রোটন দাতা হিসেবে। তবে মূল ব্যাখ্যায় আসবে দুইটা পয়েন্ট – ১. সবল এসিড ক্ষারকের ক্ষেত্রে বিয়োজন এত সুন্দর পরিমাণে ঘটে যে দ্রাবক পানির কোনো প্রভাব আলাদা করে উল্লেখের দরকারই পড়ে না এবং ২. দুর্বল অম্ল-ক্ষারকের জন্য সাম্যাবস্থায় যে নগণ্য পরিমাণ পানির অণু জড়িত থাকে এদের বিয়োজন ঘটাতে তার চেয়ে অনেক অনেক বেশিই পানি আমরা প্রারম্ভে নিই (কারণ ঘন দ্রবণ বানালে এদের বিয়োজনপ্রবণতা অনাকাঙ্ক্ষিতভাবে হ্রাস পায়, অসওয়াল্ডের লঘুকরণ সূত্র), এ কারণে বিয়োজন ধ্রুবকের লেখার সময় অবিয়োজিত পানির ঘনমাত্রা লিখে অতিরিক্ত একটা ধ্রুব রাশি আনার চিন্তা করা হয় না।
যাক সে কথা, আয়নিক ক্ষারকের জন্য সাম্য ধ্রুবক এভাবে বের করতে পারবে না তুমি কারণ তারা কেবল দ্রবীভূত হয়ে হাইড্রক্সাইড দান করা বোঝে এবং এমন বিয়োজন অধিক মাত্রায় ঘটে দেখে বিশাল কোনো সাম্য ধ্রুবক বের করার চিন্তা না করলেও চলে। তবে দুর্বল ক্ষারকগুলোর মধ্যে সবলতা তুলনা করতে এই রাশিমালা হতে প্রাপ্ত Kb এর মান খুবই কার্যকরী। এই যেমন দেখ অ্যামোনিয়া (NH3) আর অ্যানিলিন (C6H5NH2) এর জন্য Kb এর মান যথাক্রমে 1.78×10-5 molL-1 4.17×10-10 molL-1, সুতরাং অ্যামোনিয়া অবশ্যই অ্যানিলিনের চেয়ে বেশি ভাল ক্ষারক।
pKb নিয়েও আলাদা করে এখন কিছু বলার নেই। উপরের দুইটা Kb এর মানের ঋণাত্মক লগারিদম নিয়ে আমরা pKb পাই যথাক্রমে 4.75 এবং 9.38. ধনাত্মক এই মানগুলোর অর্থ এরা প্রত্যকেই দুর্বল ক্ষারক এবং যেহেতু অ্যামোনিয়ার pKb কম, এটি অ্যানিলিনের চেয়ে অধিক ক্ষারধর্মী।
সুস্থ স্বাভাবিক pH নির্ণয় (যেকোনো একাডেমিক পরীক্ষায় আলোর দিশারী 😛 )
- 0.001M HCl দ্রবণের pH কত হবে?
সুস্বাদু প্রশ্ন নিঃসন্দেহে, তাই না? 😛 HCl একটি ভাল অম্ল বিধায় এর বিয়োজন সম্পূর্ণ পরিমাণে ঘটে ধরে নেওয়া যায়, এবং প্রতিটি HCl অণু থেকে একটি প্রোটন পাওয়া যায়। তাই [H+] = [HCl] =0.001M হবে।
pH মানে দ্রবণে থাকা হাইড্রোনিয়াম আয়নের (এখানে যার স্থলে প্রোটন দিয়ে কাজ চালাচ্ছি) ঘনমাত্রার ঋণাত্মক লগারিদম। pH তাই পাব -log(0.001) = 3. pH 7 এর কম। অম্লীয় দ্রবণ বলে কথা!
এই সমস্যাতেই যদি HCl এর জায়গায় H2SO4 দেওয়া হয় তবে হিসাবে সামান্য পরিবর্তন আসবে। এবার প্রোটনের ঘনমাত্রা পাব মূল এসিডের প্রদত্ত ঘনমাত্রার দ্বিগুণ কেননা প্রতি অণু সালফিউরিক এসিড থেকে আমরা দুইটি করে প্রোটন পেতে পারি। সেক্ষেত্রে pH সুন্দর পূর্ণসংখ্যা না এসে আসবে -log(0.002) = 2.699।
- সবলরা না হয় গেল, 0.001 M CH3COOH এর pH কত?
এই প্রশ্নের জবাব দেওয়ার জন্য প্রথমত আমাদের জানা লাগবে ইথানয়িক এসিডের বিয়োজন ধ্রুবক কত। বিয়োজন ধ্রুবক না দেওয়া ছাড়া বলা সম্ভব নয় এমন দুর্বল এসিড থেকে আমরা কেমন সংখ্যক প্রোটন পেতে যাচ্ছি। বিয়োজন ধ্রুবক তাই দিয়ে দেওয়া হল 1.8×10-5 molL-1। এই এসিডের বিয়োজন এভাবে ঘটে –
CH3COOH → H+ + CH3COO–
ধরা যাক, 0.001 M ইথানয়িক এসিড থেকে উৎপন্ন প্রোটন আর এসিটেট আয়নের প্রত্যেকের ঘনমাত্রা x M
তাহলে, Ka = [H+] [CH3COO–] / [CH3COOH]
বা, 1.8×10-5 = x*x/(0.001-x)
এখন একটু কথা আছে, তুমি যদি এই অবস্থা থেকেই x এর মান বের করে আনতে চাও তবে তোমাকে ax2+bx+c=0 আকারের একটা দ্বিঘাত সমীকরণ সমাধান করার ভেতর দিয়ে যেতে হবে। কিন্তু খেয়াল কর, তোমার জানা আছে এখানে প্রোটনের ঘনমাত্রা খুব বেশিও হতে যাচ্ছে না কারণ এটা দুর্বল এসিড। x এর মান তাই অত্যল্প বিবেচনা করে 0.001-x কে তুমি কেবল 0.001 ই ভাবতে পারো। তাতে আর অমন সমীকরণ আসবে না বরং তুমি সহজেই পেয়ে যাবে x এর মান। যদিও এই মান ঐ প্রক্রিয়ায় পাওয়া মানের ন্যায় নিখুঁত হবে না, তবে এদের মধ্যে পার্থক্য হবে খুবই সামান্য।
x2 = 1.8×10-5 × 0.001
x2 = 1.8×10-8
x = 4.24×10-4
সুতরাং pH = -log(4.24×10-4) = 3.37
ঠিক এই পদ্ধতি মেনেই আমরা দুর্বল ও সবল ক্ষারকগুলোর pOH ও তদানুসারে pH নির্ণয় করতে পারব।
- 25° C এ 0.1 M NaOH দ্রবণের pH কত হবে?
ইহা আয়নিক ক্ষারক এবং তোমার ইহার বিয়োজন নিয়েও কোনো টেনশন নেই। কিন্তু তোমার টেনশন pH কীভাবে পাওয়া যাবে তা নিয়ে। আমরা আগে pOH বের করে নিই।
pOH = -log(0.1) =1
আমরা জানি, pH + pOH = pKw এবং 25° C এ pKw এর মান হল 14
সুতরাং, pH = 14 – 1 = 13, ক্ষারীয় দ্রবণের pH 7 অপেক্ষা বেশিই কাম্য।
জীবনটা এত সুন্দর সাজানো এবং সরল সমস্যার হলে মন্দ ছিল না। কিন্তু এই pH, pOH নিয়ে গোল কিন্তু কম বাধানো যায় না। আগামী পর্বে আমরা কিছু উদ্ভট সমস্যার মুখোমুখী হয়ে আরো শাণিত করে নেব আমাদের pH সংক্রান্ত ধারণা।
তোমাদের জন্য শুভকামনা।