আয়নিক যৌগ পানিতে দ্রবীভূত হয় – এ কথা কে না জানে? তবে সব যৌগের দ্রবীভূত হবার ক্ষমতা কিন্তু এক নয়। কোনো লবণ পানিতে কত পরিমাণে দ্রবীভূত হতে পারে এ থেকেই দ্রাব্যতা (Solubility) এর উৎপত্তি। এটি একটি ভৌত রাশি যা পরিমাপযোগ্য এবং রাশিটির ইংরেজি নামের আদ্যক্ষর অনুসারে একে S দ্বারা সূচিত করা হয়। কেবল দ্রাব্যতাই নয়, এ পর্বে তোমরা জানতে পারবে দ্রবণের দ্রাব্যতা গুণফল (Solubility Product) সম্পর্কেও 😀 শুভ কাজে তবে আর দেরি কেন?
সোজাসাপ্টা কথা বলি? পানিতে কোনো আয়নিক লবণের দ্রাব্যতা হল সে 1 litre পানিতে কত পরিমাণে (এই পরিমাণের প্রকাশ হতে পারে মোলসংখ্যায় অথবা নেহাত ভরে) দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ তৈরি করে। তার মানে, ঐ পরিমাণের বেশি লবণ 1 litre পানিতে দিলে তা আর দ্রবীভূত হবে না। এই পরিমাণ উষ্ণতার সাথে পরিবর্তনশীল কারণ তাপমাত্রা বাড়ালে পানি বেশি বেশি পরিমাণে দ্রবীভূত করতে পারে ঐ পদার্থ।
এই যেমন ধর AgCl এর কথা। 25°C এ তার দ্রাব্যতা 0.002 g/L যার অর্থ ঐ তাপমাত্রায় তুমি 1 litre পানিতে সর্বোচ্চ 0.002 g AgCl দ্রবীভূত করে তা সিলভার ও ক্লোরাইড আয়নে পরিণত করতে পারবে। এর চেয়ে বেশি আর এক চিমটি লবণও ঐ পানিতে আয়নিত হতে চাবে না। অন্য স্টাইলে প্রকাশ করলে এর দ্রাব্যতা 1.3 x 10-5 mol/L. কঠিন কিছুই না, ঐ একই ভরকে (0.002 g) এখানে মোলসংখ্যায় প্রকাশ করা হয়েছে কেবল (AgCl এর আণবিক ভর দিয়ে 0.002 g কে ভাগ করেই দেখ 😀 )।
এখন প্রশ্ন হচ্ছে, কোনটা প্রকাশভঙ্গিটাকে আমরা কর্মক্ষেত্রে আমাদের সঙ্গী হিসেবে বেছে নেব? এর উত্তর হচ্ছে : mol/L এককে প্রকাশের রীতিটা। কারণ হচ্ছে, এই রীতি অনুসরণ ছাড়া আমরা আমাদের সূত্রগুলোকে ব্যবহার করতে পারব না (দ্রাব্যতার সূত্রগুলো প্রতিপাদিত হয়ই এই প্রকাশভঙ্গিকে পুঁজি করে, একটু পরেই দেখবে)। তবে এটা ভুলে যেও না, দৈনন্দিন জীবনে এখনও g/L টিকে আছে বেশ জোরেশোরে।
দ্রাব্যতার উপর নির্ভর করে আমরা আয়নিক যৌগসমূহকে নানা ক্যাটাগরিতে ভাগ করতে পারি। এই যেমন দেখ, NaCl হল পানিতে অতিদ্রবণীয়, LiF কে বলতে পারি দ্রবণীয়, Ca(OH)2 হল অল্প দ্রবণীয়, Cu(OH)2 হল প্রায় অদ্রবণীয়। সরাসরি অদ্রবণীয় কাউকেই বলা যায় না কারণ অত্যল্প হলেও কিছু পরিমাণে সকলেই দ্রবীভূত হবার সক্ষমতা রাখে। এটাও বুঝতে সমস্যা হয় না যে, যার দ্রাব্যতা যত কম, তার জন্য S এর মানও তত কম হয়।
এবার শুরু আসল মজা 😛 আমরা প্রবেশ করতে যাচ্ছি দ্রাব্যতা গুণফল সংক্রান্ত আলোচনায়।
দ্রাব্যতা গুণফল এর যে সংজ্ঞা উচ্চ মাধ্যমিক বইসমূহে আছে তা একটু ভেঙ্গে বুঝানো যাক। বই বলছে, “নির্দিষ্ট তাপমাত্রায় কোনো আয়নিক যৌগের সম্পৃক্ত দ্রবণে ঐ যৌগের সংগঠক আয়নসমূহের যথোপযুক্ত ঘাতসহ মোলার ঘনমাত্রার গুণফলকে ঐ তাপমাত্রায় যৌগটির দ্রাব্যতা গুণফল বলে”।
এই সংজ্ঞা দেখে যারা ট্যাবটা কেটে দিতে চাচ্ছ তাদের বলছি একটু থামো 😛
ধরে নাও, MmAa একটা আয়নিক লবণ (M হল ক্যাটায়নের প্রতীক, A অ্যানায়নের) যার পানিতে দ্রাব্যতা S mol/L. 1 litre পানিতে এটার যেকোনো পরিমাণকে (S mol এর চেয়ে বেশি) দ্রবীভূত হতে দিলে দেখ তো এমন ঘটনা ঘটবে না?
1 litre পানিতে লবণটির কেবল S mol দ্রবীভূত হওয়াই সম্ভব। যেহেতু প্রতি অণু থেকে m mol ক্যাটায়ন উৎপন্ন হয় তাই ঐ দ্রবণে ক্যাটায়নের মোলসংখ্যা হবে mS, একইভাবে অ্যানায়নের মোলসংখ্যাও হবে aS. ক্যাট্যায়ন ও অ্যানায়নের চার্জ এরকম হল কেন তা বুঝতে হলে ম্যাগনেশিয়াম ক্লোরাইড বা ক্যালসিয়াম ফসফেটের পানিতে বিয়োজনের সাথে এটার তুলনা কর, আশা করি উত্তর পেয়ে যাবে 🙂
দ্রাব্যতার কাহিনী এখানে শেষ হলে মন্দ হত না। কিন্তু আমরা অবাক হয়ে লক্ষ্য করলাম, লবণটি পানিতে সম্পৃক্ত দ্রবণ তৈরি করার পর কিছু অতিরিক্ত লবণ (আমরা ইচ্ছা করেই বেশি বেশি নিয়েছিলাম না?) পাত্রের তলায় পড়ে আছে এবং এটার সাথে দ্রবণের কিছু একটা যেন ঘটছে!! এই কিছু একটা কী? আমরা আবিষ্কার করলাম, এমতাবস্থায় দ্রবণ থেকে কিছু পরিমাণ আয়ন আবার সলিড অবস্থায় ব্যাক করে নিচে জমছে আর একইসময়ে কিছু কঠিন লবণ বিয়োজিত হয়ে দ্রবণে ক্যাটায়ন অ্যানায়ন দান করছে! এ যেন ঠিক উভমুখী বিক্রিয়ার মত। আর হ্যাঁ, আরেকটা কথা। এই দুই বিপরীত ক্রিয়ার সংঘটনের গতিবেগও এক! তারমানে আমরা উভমুখী বিক্রিয়াটাকে সাম্যাবস্থায় উপনীত হয়েছে বলে দেখতে পাচ্ছি!! এ তো অসম্ভব!! :3
না, এটা অসম্ভব না। এটাই স্বাভাবিকভাবে ঘটে এবং এটা ঘটানোর জন্য অন্য কোনো লোকেরও প্রয়োজন পড়ে না :3
সদ্য জন্ম নেওয়া এই সাম্যাবস্থার জন্য কি তাহলে একটা সাম্যধ্রুবক আনা যায়? জ্বী অবশ্যই! তাহলে সেই সাম্যাংকের চেহারা নিশ্চয়ই এমন হওয়া উচিত –
তাহলে এই সম্পর্কটাও বৈধ হবে –
আমি এতক্ষণ একটা বিষয় খুবই অস্পষ্ট করে রেখেছি। বুঝতেই পারছ এই সমীকরণের ডানপাশে আয়নগুলোর ঘনমাত্রা বলতে আমরা দ্রবণে বিয়োজিত ক্যাটায়ন ও অ্যানায়নের ঘনমাত্রাকেই বুঝাচ্ছি। কিন্তু এই [MmAa] বলতে কী বুঝাতে চাওয়া হচ্ছে আসলে? এটা কি দ্রবণে থাকা লবণের ঘনমাত্রা? না! তা তো হতে পারে না কেননা আমরা জানি দ্রবণে আস্ত লবণের অণুর কোনো অস্তিত্ব থাকে না, তা আয়নে বিয়োজিত হয়। তাহলে এটা কি নিচের তলানি পড়া কঠিন লবণের ঘনমাত্রা? উহু, তাও না! কারণ তা ই যদি হত তাহলে আরও কঠিন লবণ যোগ করলে [MmAa] এর মান যেত বেড়ে, সেই সাথে সাম্যাংকের মান অক্ষুণ্ণ রাখতে দ্রবণে থাকা আয়নগুলোর ঘনমাত্রাও বেড়ে যেত। অথচ তুমি তাপমাত্রা বাড়াও নি পাত্রের আর তাই এটাও তুমি জানো আয়নের ঘনমাত্রা বাড়ার কোনো সুযোগই নেই দ্রবণে। কারণ এটাই সম্পৃক্ত অবস্থা, এটাই পানির লবণটাকে দ্রবীভূত করার সর্বশেষ লিমিট!
তাহলে সম্পৃক্ত অবস্থার কোনোরূপ পরিবর্তন ঘটানোর উপর কঠিন লবণেরও কোনো হাত নেই! এখন উপায়?
উপায় আছে। [MmAa] প্রকৃতপক্ষে বোঝায় ঐ লবণের 1 dm3 আয়তনে (এই আয়তন 1 litre এর সমতুল্য) ঐ লবণটি কত মোল পরিমাণে থাকে। যদি আমাদের লবণটার ঘনত্ব বলে দেওয়া হয় তাহলে এটা বের করা কোনো ব্যাপারই না! এই যেমন ধর AgCl এর ঘনত্ব 5.56 g/cm3 । এই পরিমাপটা আরেকভাবে লেখা যায় 38.8 mol/dm3 (ভরকে আণবিক ভর দিয়ে ভাগ করে মোলসংখ্যায় পরিণত করা হয়েছে ও আয়তন cm3 থেকে dm3 এ শিফট করা হয়েছে। আমাদের MmAa লবণটা যদি AgCl হতে তবে এই 38.8 mol/dm3 ই হত [MmAa] এর মান। বোঝা গেছে ব্যাপারটা?
তাহলে বুঝতেই পারছ, নির্দিষ্ট তাপমাত্রায় সম্পৃক্ত দ্রবণে আয়নসমূহের উপযুক্ত ঘাতসহ ঘনমাত্রার গুণফল একটা নির্দিষ্ট সংখ্যা হতে যাচ্ছে কারণ তাপমাত্রা নির্দিষ্ট করে দিলে সাম্যাংকের এদিক ওদিক হবার কোনো সুযোগ নেই আর তার সাথে কঠিনের ঘনত্বও একটা ধ্রুবক। দুই ধ্রুবকের গুণফলে শেষে তাই আরেকটা ধ্রুবকই পাব। এই ধ্রুবকটাই আমাদের পরম আরাধ্য দ্রাব্যতা গুণফল যাকে Ksp লেখা হয় 😀 (সাবস্ক্রিপ্টের sp আসলে solubility product-এরই সংক্ষেপণ)
এবার পড়ে দেখ ঐ খটমটে সংজ্ঞা 😛 দেখ তা আসলেই বোগাস নয় বরং সত্যই অর্থবহ।
তুমি তো আয়নগুলোর ঘনমাত্রা জানোই! ঐ যে ক্যাটায়নের মোলসংখ্যা 1 litre পানিতে mS mol বের করলে না? তাহলে এর ঘনমাত্রা mS mol/L ভিন্ন কিছু কী হবে? তেমন করে অ্যানায়নের ঘনমাত্রাও তো aS mol/L আসা উচিত, তাই নয় কী? এই মানগুলো আমরা সরাসরি ঘনমাত্রার জায়গায় বসিয়ে দিলে দেখ কীভাবে দ্রাব্যতা গুণফল তার রূপ বদলায়
শেষ লাইনে যে রাশিটা পেলাম আমরা, এটা কোনো লবণের দ্রাব্যতা ব্যবহার করে কীভাবে দ্রাব্যতা গুণফল পাওয়া যায় তা নির্দেশ করে। যেমন ধর, NaCl এর দ্রাব্যতা S হলে দ্রাব্যতা গুণফলের মান হবে 11 . 11 . S1+1 বা S2। লক্ষ্য কর, নির্দিষ্ট তাপমাত্রায় কোনো আয়নিক যৌগের S নির্দিষ্ট বলে Ksp ও নির্দিষ্ট হতে বাধ্য। আরেকটা কথা Ksp অবশ্যই এবং অবশ্যই সম্পৃক্ত দ্রবণের জন্য নির্ণয়যোগ্য। তুমি একটা অসম্পৃক্ত দ্রবণ দিয়ে Ksp এর মান নির্ণয় করে দিতে বললে কিন্তু হবে না। Ksp এর একক আছে এবং তা পরিবর্তনশীল (S এর ঘাত একেকরকম হলে তা একেকরকম মান নেয়)। অনেক ক্ষেত্রেই তাই ঝামেলা না করে Ksp এর কেবল মানটাই উল্লেখ করে, একক দেওয়া হয় না।
আগামী পর্বে আমরা কিছু গাণিতিক সমস্যা দেখে এই ঝামেলাপূর্ণ ও সমস্যাযুক্ত টপিকের ইতি টানব 😀
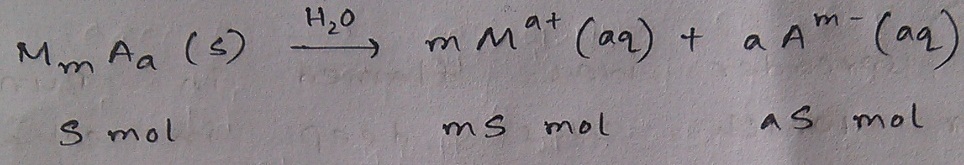
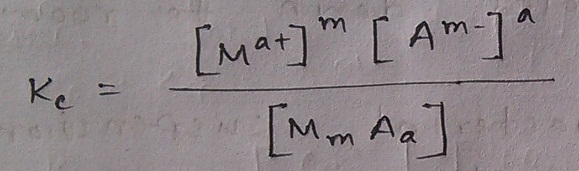

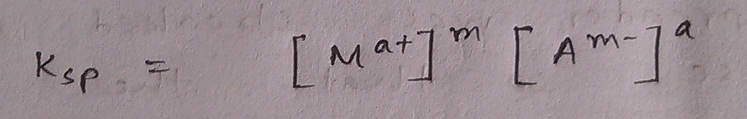
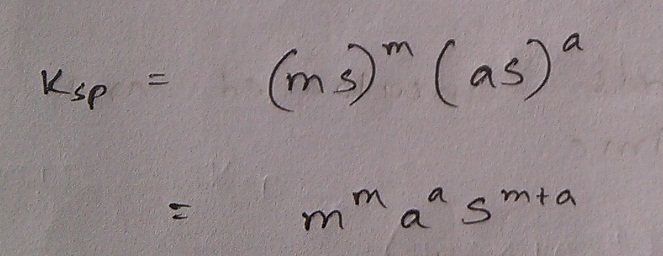
অনেক উপকৃত হয়েছি
ধন্যবাদ মন্তব্যের জন্য 😀
tnq
অসাধারন